Uzdatnianie wody, Filtry do wody - BLOG
Struktura Wody
Opublikowany przez Eko - Art w kategorii Uzdatnianie wody • 2017-10-29 19:17:56
Struktura Wody składa się tylko z dwóch atomów - wodoru i tlenu. Wszystkie atomy istniejące na świecie składają się z jądra (protonów / neutronów) otoczonych przez jeden lub więcej elektronów wirujących wokół jądra. Ponieważ elektrony poruszają się z prędkością zbliżoną do prędkości światła, to ich orbity bardziej przypominają "chmury", a nie wyraźnie określone szlaki. W obrębie tych chmur są warstwy lub orbity elektronów. Pierwsza skorupa elektronów zawiera jedną orbitę, która może pomieścić do dwóch elektronów.
Kiedy pierwsza powłoka elektronów jest kompletna (co oznacza, że ??zawiera dwa elektrony), jest wówczas stabilna. Druga osłona elektronów może zawierać do ośmiu elektronów cztery różne orbity o dwóch elektronach każda. Podobnie jak pierwsza powłoka, jest ona najbardziej stabilna, gdy jest ona kompletna - w tym przypadku z ośmioma elektronami (znanymi jako "reguła oktetu"). Liczba elektronów w skorupie zewnętrznej (zwanej skorupą walencyjną) determinuje chemiczną reaktywność atomów. Atomy są tylko usatysfakcjonowane lub "szczęśliwe", jeśli mają pełną zewnętrzną powłokę elektronów, co oznacza, że ??zrobią wszystko, co potrzeba, aby zyskać lub zgubić elektrony w celu ukończenia ich powłoki zewnętrznej.
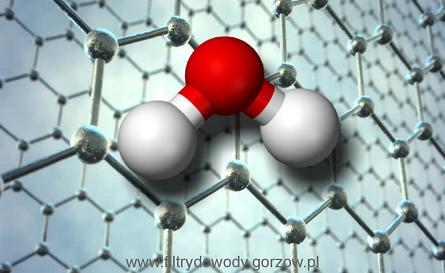
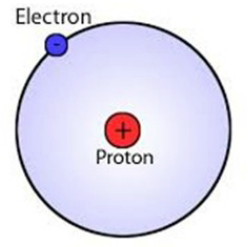
Liczba protonów (znana jako liczba atomowa) określa, jaki element jest atomem. Liczba i położenie elektronów w ich orbitalach decyduje o zachowywaniu się atomu. Jak widać z prostego diagramu poniżej, atom wodoru, będący pierwszym elementem układu okresowego, zawiera tylko jeden proton i jeden elektron. Pozostawia to puste miejsce w swojej pierwszej i jedynej obudowie elektronów. Proton (czerwony) ma ładunek dodatni, a elektron (niebieski) nosi ładunek ujemny. Ponieważ dodatnie i ujemne ładunki wzajemnie się wycofują, cały atom wodoru jest neutralny.
Oto jak wygląda atom wodoru.
Oto jak wygląda atom tlenu.
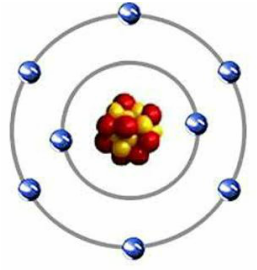
Ma osiem dodatnio naładowanych protonów i osiem neutronów w jej jądrze z ośmioma elektronami pędzącymi wokół jądra na dwóch różnych poziomach orbitalnych. Żółte neutrony są obojętne w ładunku i nie przyczyniają się do ładunku netto cząsteczki wody. Aby powłoka zewnętrzna atomu tlenu została ukończona, konieczne byłoby uzyskanie dwóch dodatkowych elektronów w sumie ośmiu elektronów. W wodzie (H2O) dwa dodatkowe elektrony są dostarczane przez dwa atomy wodoru, dzielące ich elektrony atomem tlenu. ?? Kiedy dwa lub więcej atomów współdzieli elektrony, tworzą więź między nimi nazywaną "wiązaniami kowalencyjnymi". "
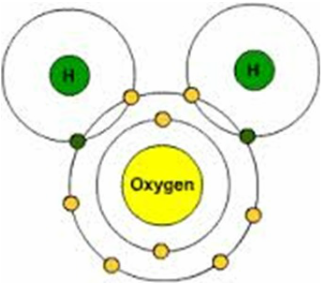
Bardzo drobna cząsteczka wody ma kształt trójkąta. Niebieską kulą jest atom tlenu, a czerwone kule to dwa atomy wodoru. Pręty między atomem tlenu a wodorem reprezentują wiązania molekularne
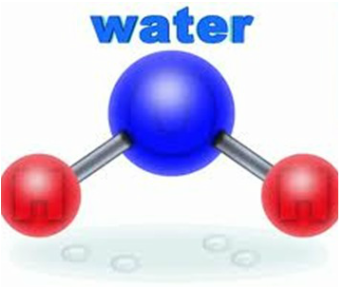
Pomyśl o więzach jako sprężynach, które można wygiąć i rozciągać, aby przechowywać informacje i nadmiar energii . Jak widać na rysunku poniżej, gdy atom wodoru i tlenu spotykają się tworząc cząsteczkę wody, dziesięć elektronów łączy się w pięciu "orbitalach" , jedna para ściśle związana z atomem tlenu w jego wewnętrznej muszli, dwie pary (pojedyncze pary ) związany z atomem tlenu jako "zewnętrznymi" elektronami, a dwie pary tworzą każdy z dwóch identycznych wiązań tlenu i wodoru.
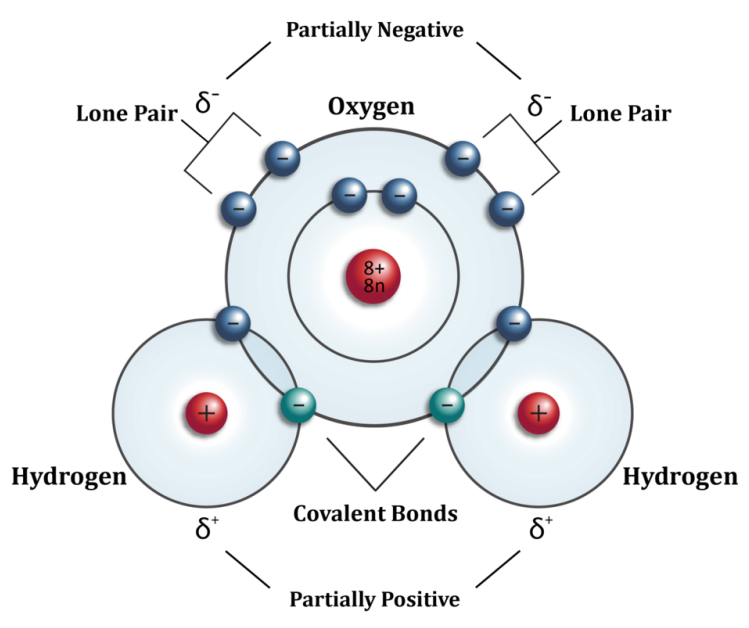
Każda cząsteczka wody jest elektrycznie neutralna, ale biegunowa, co oznacza, że ??centra ładunków dodatnich i ujemnych znajdują się w różnych miejscach na cząsteczce. Ze względu na stosunkowo duży ładunek dodatni z ośmiu protonów w jądrze atomu tlenu (8+) i bliskość jej elektronów, atom tlenu ma silniejszą atrakcję dla wszystkich elektronów niż atomów wodoru z jednym protonem (1+). Prowadzi to do przesunięcia ładunku z atomów wodoru w kierunku atomu tlenu. W związku z tym, polaryzacja cząsteczki wody sprawia, że ??koniec tlenu cząsteczki jest częściowo ujemny, a wodór kończy się częściowo pozytywnie.
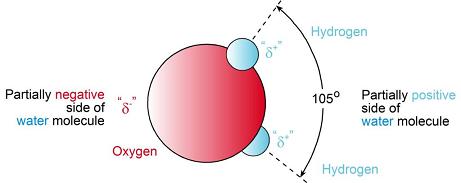
Wiele właściwości fizycznych i chemicznych wody jest spowodowane jego strukturą. Atomy w cząsteczce wody są rozmieszczone z dwoma wiązaniami wodorowo-tlenowymi (HO) pod kątem około 105 °, a nie na przeciwnych stronach atomu tlenu. Asymetryczny kształt cząsteczki powstaje z tendencji czterech par elektronów w skorupie walencyjnej tlenu, aby układać się symetrycznie na wierzchołkach czworościanu wokół jądra tlenu. Dwie pary kojarzone z wiązaniami kowalencyjnymi trzymającymi atomy wodoru są lekko rozciągane, powodując kąt między nimi 105 °.
Wiązanie wodorowe
Z powyższych zdjęć i wyjaśnień już rozumiesz, że cząsteczka wody jako całość ma pozytywną i negatywną stronę. Jak wszyscy wiemy, przeciwieństwa przyciągają. To samo z cząsteczkami wody. W optymalnych warunkach cząsteczki wody przyciągają się nawzajem w precyzyjnych geometrycznych wzorach zwanych "klastrami", z dodatnim końcem jednej cząsteczki wody wyrównanej negatywną stroną innej cząsteczki wody. Ta atrakcja nazywa się "dipolem elektrycznym".
Elektryczny dipol powoduje powstanie atrakcji pomiędzy sąsiednimi przeciwległymi końcami cząsteczek wody, przy czym każda cząstka tlenu może przyciągnąć dwa pobliskie atomy wodoru dwóch innych cząsteczek wody. Takie wiązanie wodorowe obserwowano także w innych związkach wodorowych. Chociaż znacznie niższe od kowalencyjnych wiązań utrzymujących cząsteczkę wody razem, wiązanie wodorowe jest wystarczająco mocne, aby utrzymywać wodę w stanie ciekłym w normalnych temperaturach, mimo że jego niska masa cząsteczkowa zazwyczaj powodowała, że ??była gazem w takich temperaturach.
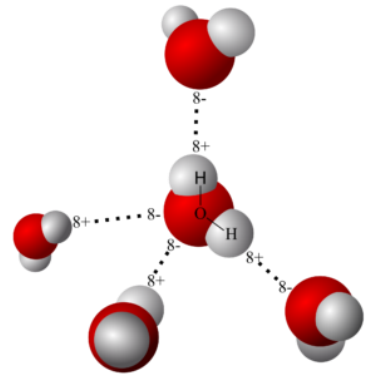
Do tych wiązań wodorowych należą inne właściwości wody, takie jak wysokie ciepło właściwe. Gdy temperatura wody jest obniżona, klastry cząsteczek zaczynają się tworzyć poprzez wiązanie wodorowe (jak pokazano na wykresie przedstawiającym linie przerywane), przy czym każda cząsteczka jest połączona z innymi przez maksymalnie cztery wiązania wodorowe i każdy atom tlenu,
który ma się otoczyć czterema atomami wodoru w układzie czworościennym (lub czterostronnym). Atomy tlenu w grupach tetraedrycznych zaczynają wiązać się z atomami wodoru w innych czterowartościowych klastrach, które powodują powstanie sześciokątnego kształtu płatka śniegu, który wszyscy tak dobrze znamy. Ponieważ cząsteczki wody tworzą wiązania wodorowe z sąsiednimi cząsteczkami wody , woda ma bardzo nietypowe anomalie.
http://filtrywodne.blogspot.com/


Kiedy pierwsza powłoka elektronów jest kompletna (co oznacza, że ??zawiera dwa elektrony), jest wówczas stabilna. Druga osłona elektronów może zawierać do ośmiu elektronów cztery różne orbity o dwóch elektronach każda. Podobnie jak pierwsza powłoka, jest ona najbardziej stabilna, gdy jest ona kompletna - w tym przypadku z ośmioma elektronami (znanymi jako "reguła oktetu"). Liczba elektronów w skorupie zewnętrznej (zwanej skorupą walencyjną) determinuje chemiczną reaktywność atomów. Atomy są tylko usatysfakcjonowane lub "szczęśliwe", jeśli mają pełną zewnętrzną powłokę elektronów, co oznacza, że ??zrobią wszystko, co potrzeba, aby zyskać lub zgubić elektrony w celu ukończenia ich powłoki zewnętrznej.
Liczba protonów (znana jako liczba atomowa) określa, jaki element jest atomem. Liczba i położenie elektronów w ich orbitalach decyduje o zachowywaniu się atomu. Jak widać z prostego diagramu poniżej, atom wodoru, będący pierwszym elementem układu okresowego, zawiera tylko jeden proton i jeden elektron. Pozostawia to puste miejsce w swojej pierwszej i jedynej obudowie elektronów. Proton (czerwony) ma ładunek dodatni, a elektron (niebieski) nosi ładunek ujemny. Ponieważ dodatnie i ujemne ładunki wzajemnie się wycofują, cały atom wodoru jest neutralny.
Oto jak wygląda atom wodoru.

Oto jak wygląda atom tlenu.

Ma osiem dodatnio naładowanych protonów i osiem neutronów w jej jądrze z ośmioma elektronami pędzącymi wokół jądra na dwóch różnych poziomach orbitalnych. Żółte neutrony są obojętne w ładunku i nie przyczyniają się do ładunku netto cząsteczki wody. Aby powłoka zewnętrzna atomu tlenu została ukończona, konieczne byłoby uzyskanie dwóch dodatkowych elektronów w sumie ośmiu elektronów. W wodzie (H2O) dwa dodatkowe elektrony są dostarczane przez dwa atomy wodoru, dzielące ich elektrony atomem tlenu. ?? Kiedy dwa lub więcej atomów współdzieli elektrony, tworzą więź między nimi nazywaną "wiązaniami kowalencyjnymi". "

Bardzo drobna cząsteczka wody ma kształt trójkąta. Niebieską kulą jest atom tlenu, a czerwone kule to dwa atomy wodoru. Pręty między atomem tlenu a wodorem reprezentują wiązania molekularne

Pomyśl o więzach jako sprężynach, które można wygiąć i rozciągać, aby przechowywać informacje i nadmiar energii . Jak widać na rysunku poniżej, gdy atom wodoru i tlenu spotykają się tworząc cząsteczkę wody, dziesięć elektronów łączy się w pięciu "orbitalach" , jedna para ściśle związana z atomem tlenu w jego wewnętrznej muszli, dwie pary (pojedyncze pary ) związany z atomem tlenu jako "zewnętrznymi" elektronami, a dwie pary tworzą każdy z dwóch identycznych wiązań tlenu i wodoru.

Każda cząsteczka wody jest elektrycznie neutralna, ale biegunowa, co oznacza, że ??centra ładunków dodatnich i ujemnych znajdują się w różnych miejscach na cząsteczce. Ze względu na stosunkowo duży ładunek dodatni z ośmiu protonów w jądrze atomu tlenu (8+) i bliskość jej elektronów, atom tlenu ma silniejszą atrakcję dla wszystkich elektronów niż atomów wodoru z jednym protonem (1+). Prowadzi to do przesunięcia ładunku z atomów wodoru w kierunku atomu tlenu. W związku z tym, polaryzacja cząsteczki wody sprawia, że ??koniec tlenu cząsteczki jest częściowo ujemny, a wodór kończy się częściowo pozytywnie.
Wiele właściwości fizycznych i chemicznych wody jest spowodowane jego strukturą. Atomy w cząsteczce wody są rozmieszczone z dwoma wiązaniami wodorowo-tlenowymi (HO) pod kątem około 105 °, a nie na przeciwnych stronach atomu tlenu. Asymetryczny kształt cząsteczki powstaje z tendencji czterech par elektronów w skorupie walencyjnej tlenu, aby układać się symetrycznie na wierzchołkach czworościanu wokół jądra tlenu. Dwie pary kojarzone z wiązaniami kowalencyjnymi trzymającymi atomy wodoru są lekko rozciągane, powodując kąt między nimi 105 °.

Wiązanie wodorowe
Z powyższych zdjęć i wyjaśnień już rozumiesz, że cząsteczka wody jako całość ma pozytywną i negatywną stronę. Jak wszyscy wiemy, przeciwieństwa przyciągają. To samo z cząsteczkami wody. W optymalnych warunkach cząsteczki wody przyciągają się nawzajem w precyzyjnych geometrycznych wzorach zwanych "klastrami", z dodatnim końcem jednej cząsteczki wody wyrównanej negatywną stroną innej cząsteczki wody. Ta atrakcja nazywa się "dipolem elektrycznym".
Elektryczny dipol powoduje powstanie atrakcji pomiędzy sąsiednimi przeciwległymi końcami cząsteczek wody, przy czym każda cząstka tlenu może przyciągnąć dwa pobliskie atomy wodoru dwóch innych cząsteczek wody. Takie wiązanie wodorowe obserwowano także w innych związkach wodorowych. Chociaż znacznie niższe od kowalencyjnych wiązań utrzymujących cząsteczkę wody razem, wiązanie wodorowe jest wystarczająco mocne, aby utrzymywać wodę w stanie ciekłym w normalnych temperaturach, mimo że jego niska masa cząsteczkowa zazwyczaj powodowała, że ??była gazem w takich temperaturach.

Do tych wiązań wodorowych należą inne właściwości wody, takie jak wysokie ciepło właściwe. Gdy temperatura wody jest obniżona, klastry cząsteczek zaczynają się tworzyć poprzez wiązanie wodorowe (jak pokazano na wykresie przedstawiającym linie przerywane), przy czym każda cząsteczka jest połączona z innymi przez maksymalnie cztery wiązania wodorowe i każdy atom tlenu,
który ma się otoczyć czterema atomami wodoru w układzie czworościennym (lub czterostronnym). Atomy tlenu w grupach tetraedrycznych zaczynają wiązać się z atomami wodoru w innych czterowartościowych klastrach, które powodują powstanie sześciokątnego kształtu płatka śniegu, który wszyscy tak dobrze znamy. Ponieważ cząsteczki wody tworzą wiązania wodorowe z sąsiednimi cząsteczkami wody , woda ma bardzo nietypowe anomalie.
http://filtrywodne.blogspot.com/
Brak komentarzy